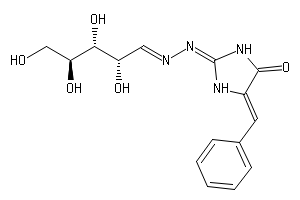
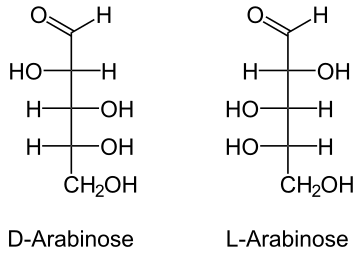
L-アラビノースオペロン(英: L-arabinose operon)はaraオペロンまたはaraBADオペロンとも呼ばれ、大腸菌Escherichia coliにおいて五炭糖のL-アラビノースを分解するために必要なオペロンである。L-アラビノースオペロンにはaraB、araA、araDの3つの構造遺伝子(まとめてaraBADと呼ばれる)が含まれており、これらはL-アラビノースの代謝に必要な3つの酵素をコードしている。これらの遺伝子から産生されるAraB(リブロキナーゼ)、AraA(イソメラーゼ)、AraD(エピメラーゼ)は、L-アラビノースをペントースリン酸経路の中間体であるD-キシルロース-5-リン酸へ変換する。
L-アラビノースオペロンの構造遺伝子は共通のプロモーターから1本の転写産物(mRNA)として転写される。L-アラビノースオペロンの発現は、araC調節遺伝子の産物とカタボライト活性化タンパク質(CAP)-cAMP複合体によって、単一のユニットとして制御される。調節タンパク質AraCはアラビノースレベルに対する感受性があり、アラビノース存在下でのアクチベーター、アラビノース不在下のリプレッサーとしての二重の機能によってaraBADの発現を調節する。AraCタンパク質はaraBADの発現を制御するだけでなく、AraCのレベルが高い場合に自身の発現の自己制御も行う。
構造
L-アラビノースオペロンは構造遺伝子と、オペレーター領域(araO1、araO2)とイニシエーター領域(araI1、araI2)を含む調節領域から構成される。構造遺伝子であるaraB、araA、araDはL-アラビノースの異化に関する酵素をコードしている。また、CAP-cAMP複合体が結合してカタボライト抑制を促進するCAP結合部位が存在し、細胞のグルコース欠乏時にaraBADを正に調節する。
調節遺伝子であるaraCは、L-アラビノースオペロンの上流に位置し、アラビノース応答性調節タンパク質AraCをコードしている。 araCとaraBADにはそれぞれ異なるプロモーターが存在し、RNAポリメラーゼの結合と転写の開始は個別に行われる。araBADとaraCは、それぞれaraBADプロモーター(PBAD)とaraCプロモーター(PC)から逆方向に転写される。
機能
- araAはL-アラビノースイソメラーゼをコードし、L-アラビノースとL-リブロースの間の異性化を触媒する。
- araBはリブロキナーゼをコードし、L-リブロースのリン酸化を触媒してL-リブロース-5-リン酸を形成する。
- araDはL-リブロース-5-リン酸-4-エピメラーゼをコードし、L-リブロース-5-リン酸とD-キシルロース-5-リン酸の間のエピマー化を触媒する。
L-リブロース-5-リン酸とD-キシルロース-5-リン酸はどちらも、ペントースの代謝とヘキソースの代謝を関連付けるペントースリン酸経路の代謝産物である。
調節
L-アラビノースシステムは、CAP-cAMPアクチベーターだけでなく、AraCタンパク質の結合によっても正または負に制御されている。AraCはホモ二量体として機能し、L-アラビノースオペロンのオペレーター領域とイニシエーター領域との相互作用によってaraBADの転写を制御する。AraCの各単量体は、DNA結合ドメインと二量体化ドメインの2つのドメインから構成される。二量体化ドメインはアラビノースの結合を担う。アラビノースの結合に伴ってAraCはコンフォメーションが変化し、そのためAraCには2つの異なるコンフォメーションが存在する。AraCのコンフォメーションは、アロステリックなインデューサーであるアラビノースの結合によって純粋に決定される。
またAraCは、自身の濃度が高くなりすぎた際に自身の発現を負に自己制御する。AraCの合成は、オペレーター領域(araO1)への二量体型AraCの結合によって抑制される。
araBADの負の調節
アラビノースが存在しないときには、細胞はアラビノースを分解するaraBADの産物を必要としない。そのため、二量体型AraCがリプレッサーとして機能する。一方の単量体がaraBADのオペレーター(araO2)に結合し、もう一方の単量体はaraI1と呼ばれる離れたDNA領域に結合する。これによってDNAのループが形成され、araBADのプロモーターへのRNAポリメラーゼの結合がブロックされる。そのため、araBADの構造遺伝子の転写が阻害される。
araBADの正の調節
araBADオペロンの発現は、グルコースが存在せずアラビノースが存在するときに活性化される。アラビノース存在下では、AraCとCAPの双方が協働してアクチベーターとして機能する。
AraCを介した調節
AraCはアラビノースの存在下でアクチベーターとして機能する。AraCの二量体化ドメインにアラビノースが結合すると、AraCにはコンフォメーション変化が生じる。その結果、AraC-アラビノース複合体はaraO2から解離し、DNAのループ構造が破壊される。AraC-アラビノース複合体にとっては、2つの近接した部位(araI1とaraI2)に結合する方がエネルギー的に有利となる。一方の単量体がaraI1に結合し、もう一方の単量体がaraI2に結合する。言い換えれば、AraCのへaraI2の結合は、アラビノースによってアロステリックに誘導される。この配置ではAraCの単量体の1つはaraBADプロモーターの近傍に位置し、RNAポリメラーゼがプロモーターに結合して転写を開始するのを助ける。
CAP/cAMPを介した調節(カタボライト抑制)
大腸菌が好む糖であるグルコースの不在下でのみ、CAPは転写のアクチベーターとして機能する。グルコースの不在下では、araI1とaraO1の間に位置するCAP結合部位に対し、CAP-AMP複合体が高いレベルで結合する。CAP-cAMPの結合はaraI1とaraO2の間のDNAループ構造を開き、AraCタンパク質のaraI2に対する結合親和性を高めることでaraBADプロモーターへのRNAポリメラーゼの結合を促進し、L-アラビノースの代謝に必要なaraBADの発現のスイッチを入れる。
AraCの自己調節
araCの発現は、自身のタンパク質産物であるAraCによって負に制御されている。過剰なAraCはaraC遺伝子のオペレーターであるaraO1に結合し、高レベルのAraCはRNAポリメラーゼがaraCプロモーターにアクセスするのを物理的にブロックする。すなわち、AraCタンパク質は高濃度では自身の発現を阻害する。
タンパク質発現系での利用
L-アラビノースオペロンは1970年以降分子生物学研究において注目され続けており、遺伝学、生化学、生理学、生物工学のレベルでの広く研究が行われている。L-アラビノースオペロンはタンパク質発現系で広く利用されており、緊密な制御下で標的遺伝子の発現を行うためにaraBADプロモーターが利用されている。araBADプロモーターを標的遺伝子と融合することで、標的遺伝子の発現をアラビノースのみによって調節することができるようになる。例えば、pGLO プラスミドはPBADプロモーターの制御下に緑色蛍光タンパク質(GFP)遺伝子を含んでおり、アラビノースによってGFPの産生が誘導される。
出典
関連項目
- オペロン
- 異化 (生物学)
- カタボライト抑制
大腸菌の他のオペロンシステム
- ガラクトースオペロン
- ラクトースオペロン
- トリプトファンオペロン
- gabオペロン
外部リンク
- Modern Genetic Analysis by Griffiths, A.J et al. (online textbook)
- Biochemistry by Berg, J.M et al. (online textbook)
- An Introduction to Genetic Analysis by Griffiths, A.J et al. (online textbook)